探索活性分子發揮效應的 “神秘“ 機制_MedChemExpress(MCE 中國)

當找到有效的活性分子后......
這些分子的作用靶點是什么?
如何發揮它們的生物學效應?
本期咱們一起探討藥物找靶的新策略,Let’s Go!
Section.01
藥物靶點的識別
明確藥物的臨床適用范圍是藥物發現與設計的關鍵,除此之外,闡明藥物的作用靶點也在疾病的發生發展中扮演重要角色。
諾貝爾生理學或醫學獎得主 Paul Ehrlich 曾說過“corpora non agunt nisi fixate”—— 藥物不會發揮作用,除非它們被結合。《牛津生物化學與分子生物學詞典》將藥物靶點定義為與特定化合物相互作用并受其活性調節的生物實體,通常是蛋白質或基因。
1. 在某種疾病的病理生理中有確鑿的作用,和/或能夠改變疾病進程;
2. 在全身范圍內的非均勻分布;
3. 有可用于評估成藥性的三維結構;
4. 易于進行“檢測”,便于高通量篩選;
5. 具有良好的毒性特征,可以通過表型數據預測潛在的不良反應;
6. 具有有利的知識產權 (IP) 狀態 (這一點主要與新藥研發公司相關)。
新藥發現主要分為基于靶點的藥物發現 (Target-based drug discovery, TDD) 和基于表型的藥物發現 (Phenotypic drug discovery, PDD)。對于 PDD 來說,從大規模化合物中篩選并驗證得到活性分子后,進一步發現并闡明其作用靶點更是至關重要!
藥物靶點識別的方法主要分為計算機預測與實驗找靶。
計算機預測通常利用數據挖掘、藥效團模型匹配、正反分子對接技術和藥物-靶標相似性算法等,識別小分子可能作用的靶點。下面是一些常用的靶標預測網站,有需可參考喔~
表 1. 常用的靶標預測網站。





雖然通過預測的方法能夠快速篩選出大量潛在靶點,但精準度相對不高,而且通常無法定位到某種細胞或組織中。由于靶點可能在不同的細胞中表達水平不同或發揮不同的作用,這種缺乏細胞特異性的預測可能會導致在實驗驗證階段的失敗。
實驗找靶則是通過具體的生物實驗來篩選靶點,其底層邏輯一般是通過各種實驗方法找到細胞或組織中能夠與藥物結合的潛在蛋白,而后通過結合層面和功能層面的雙重驗證來確認靶點在疾病中的作用以及藥物可以通過調節該靶點功能從而發揮藥效。這不僅能夠提高靶點篩選的準確性,也為靶點選擇提供了更豐富的生物學背景,使得藥物研發更具針對性和有效性。
實驗找靶常用的方法主要有 DARTS、SPR 和 Pulldown 技術等,且看小 M 為大家逐一介紹~
Section.02
DARTS 找靶技術
藥物親和反應靶點穩定性(Drug affinity responsive target stability, DARTS)的概念最初由 Brett Lomenick 等人于 2009 年提出,其基本原理是靶蛋白與小分子配體結合后穩定性增加,可以增強靶蛋白對蛋白酶酶解作用的抗性,以此來進行靶蛋白篩選,同時無需對小分子進行修飾[2]。
DARTS 找靶的一般實驗流程:
1. 蛋白庫的制備 (通常為目標細胞或組織的蛋白裂解液);
2. 蛋白裂解液與小分子共孵育;
3. 蛋白酶水解 (合適的蛋白酶濃度至關重要);
4. 通過考馬斯亮藍染色或銀染等方法檢測對照組和加藥組蛋白的差異;
5. 目標蛋白凝膠條帶收集;
6. 通過質譜等方法對目標蛋白進行鑒定。
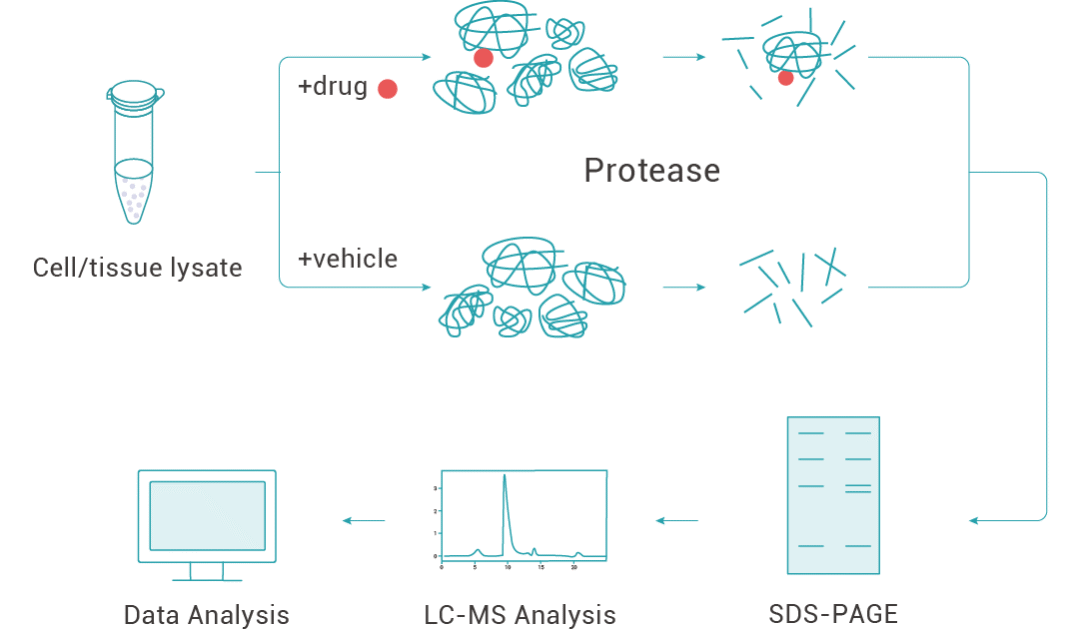
圖 1. 利用 DARTS 技術找靶的流程。
作者通過表型篩選及驗證發現藥物 desloratadine 在體內和體外實驗中都能夠顯著抑制肝細胞癌 (HCC) 的生長和增殖。為了探究 desloratadine 發揮抗癌生物活性的分子機制,作者通過 DARTS 實驗發現了 53 種潛在靶蛋白,并從中選擇了 5 種感興趣的蛋白質修飾酶進行進一步研究。通過蛋白表達、Knockdown、細胞增殖、細胞侵襲和遷移以及體內實驗等驗證了 desloratadine 通過靶向 NMT1 蛋白調節 HCC 的發展,利用 SPR 技術驗證了 desloratadine 和 NMT1 蛋白的結合,通過分子對接、蛋白點突變聯合 SPR 技術找到了 desloratadine 和 NMT1 蛋白的結合位點。
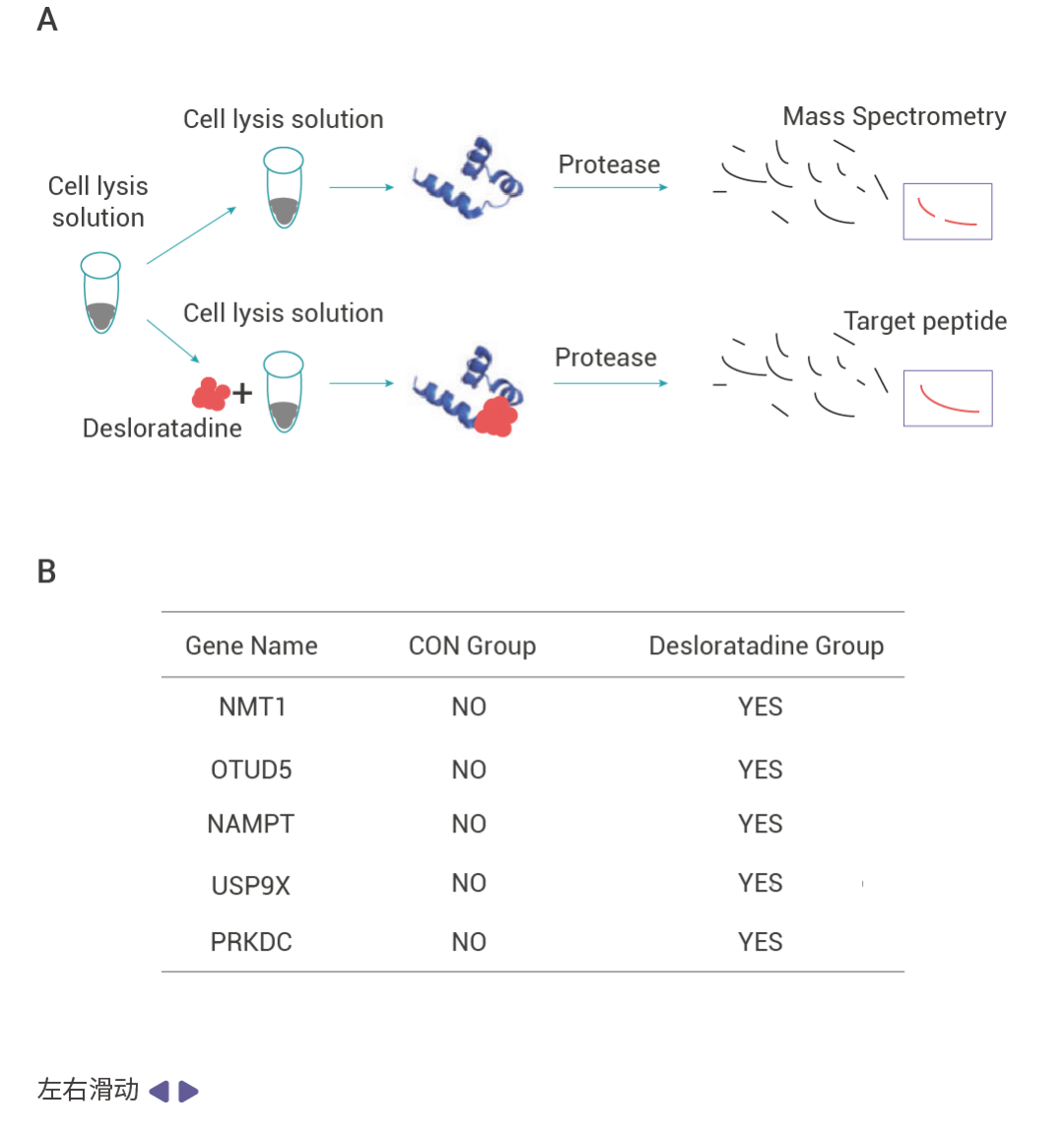
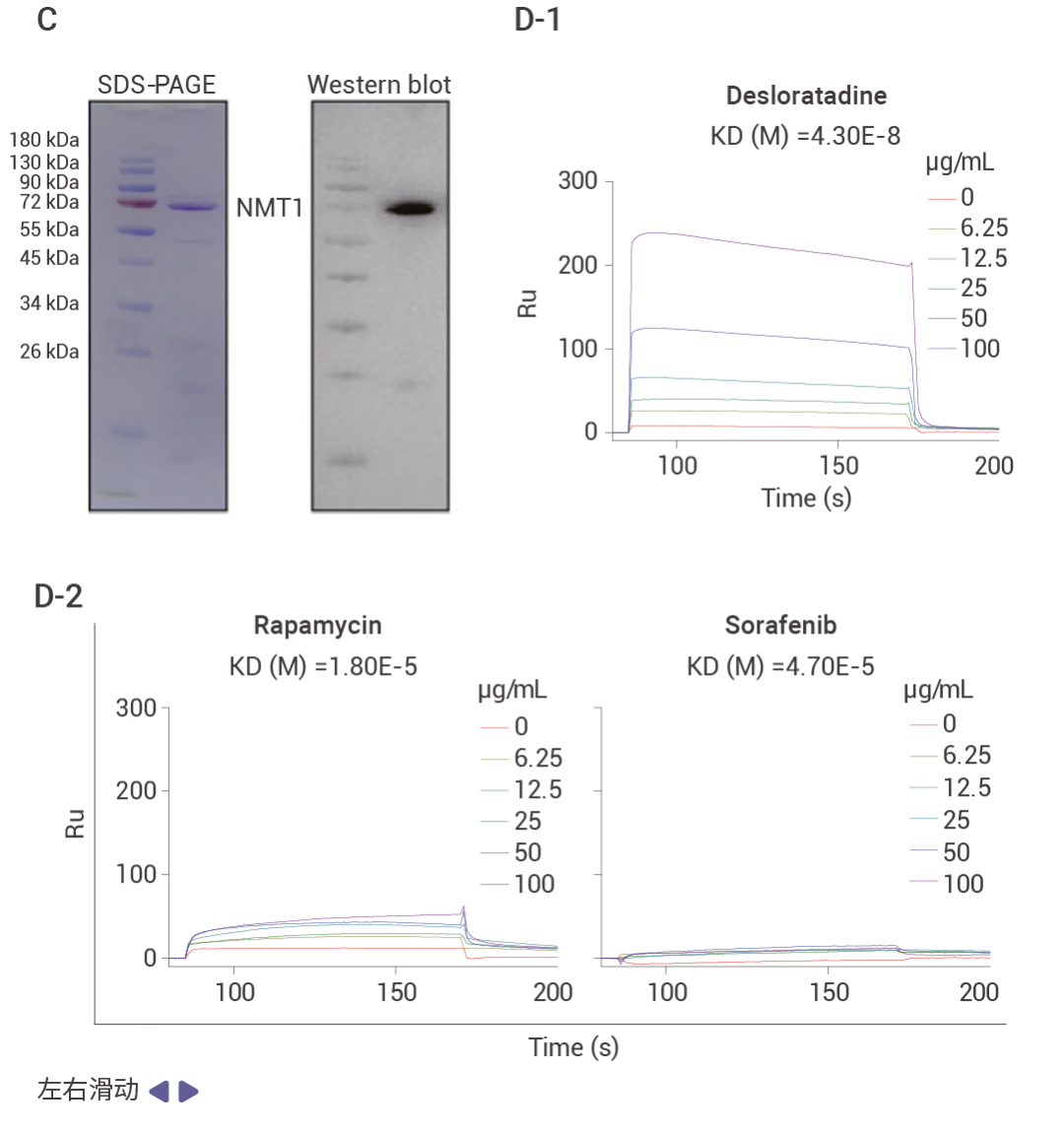
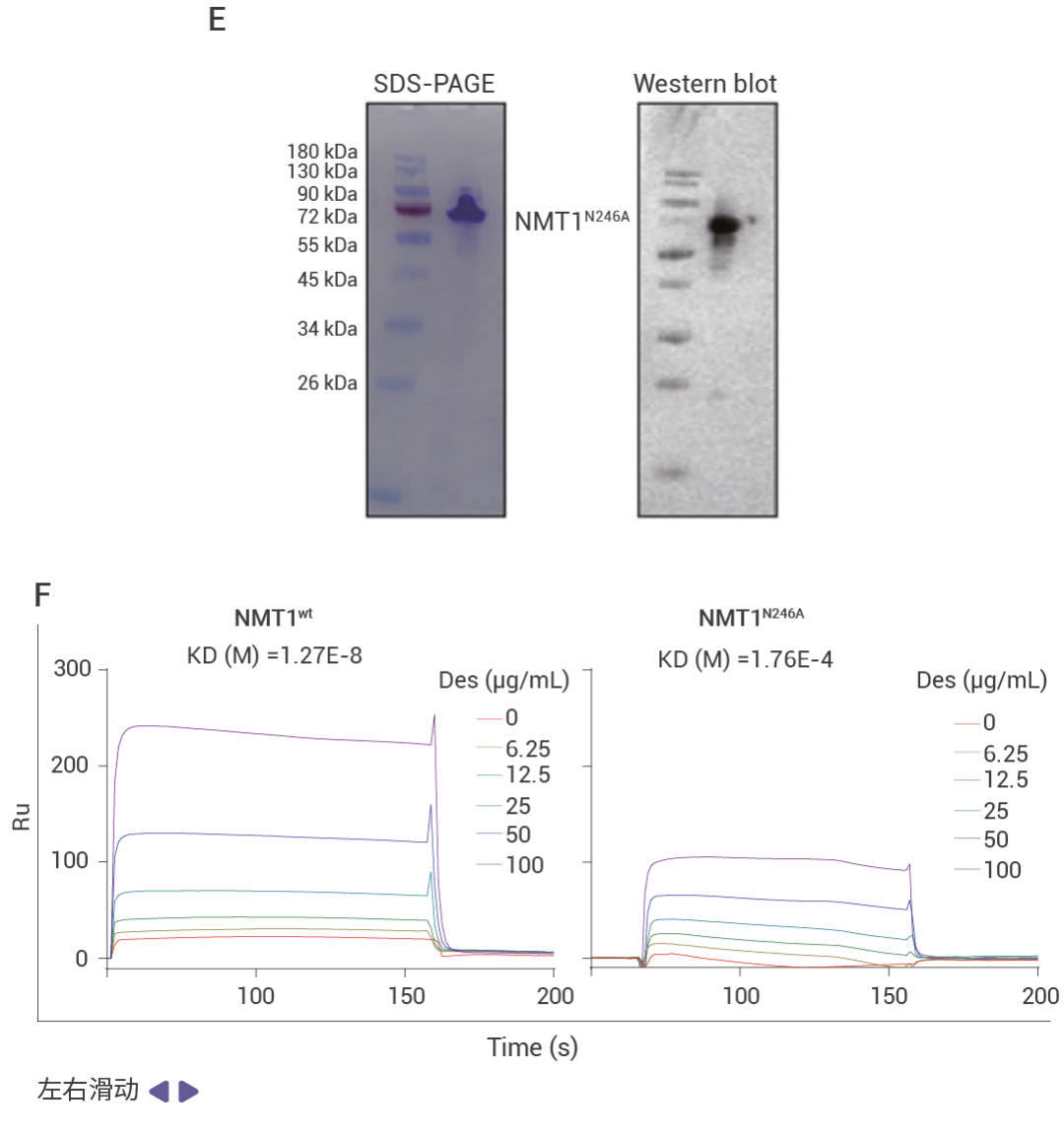
圖 2. 利用 DARTS 技術發現 desloratadine 通過靶向 NMT1 蛋白調節 HCC 的發展[3]。
Section.03
SPR 找靶技術
表面等離子共振 (Surface Plasmon Resonance, SPR) 是一種無標記、實時檢測分子相互作用的技術。它基于表面等離子共振原理,實時監測分子在固體表面 (通常是金屬表面) 上的結合與解離過程。
雖然 SPR 實驗通常用來檢測兩個分子之間的相互作用,但是 SPR 的這一特性也使其可以用于從復雜樣品中“垂釣”與藥物相互作用的分子。
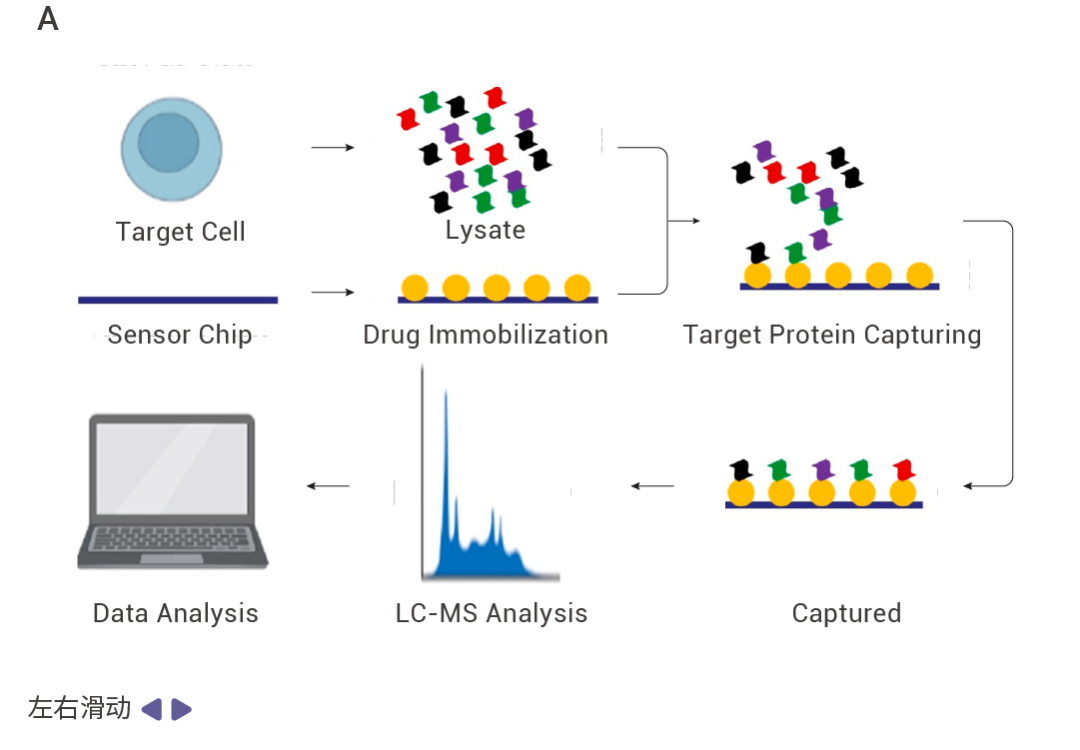
實驗時,將藥物固定在芯片上,蛋白裂解液稀釋為不同濃度,采用多濃度上樣的方式,將不同濃度的裂解液與藥物互作,收集與小分子結合的蛋白并通過高分辨質譜進行鑒定,從而得到藥物的潛在靶蛋白。同時,SPR 技術也常用于靶蛋白與藥物的親和力驗證。
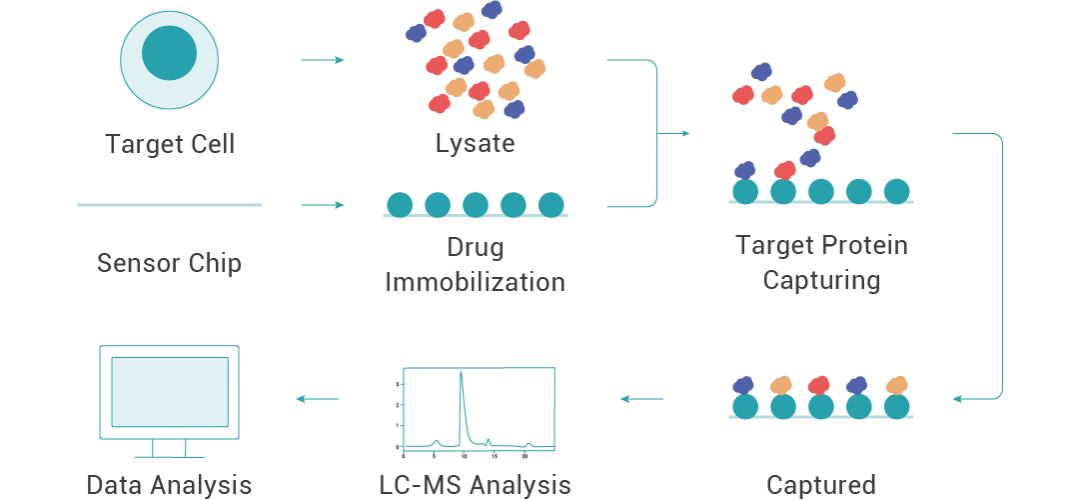
圖 3. 利用 SPR 技術找靶的流程。
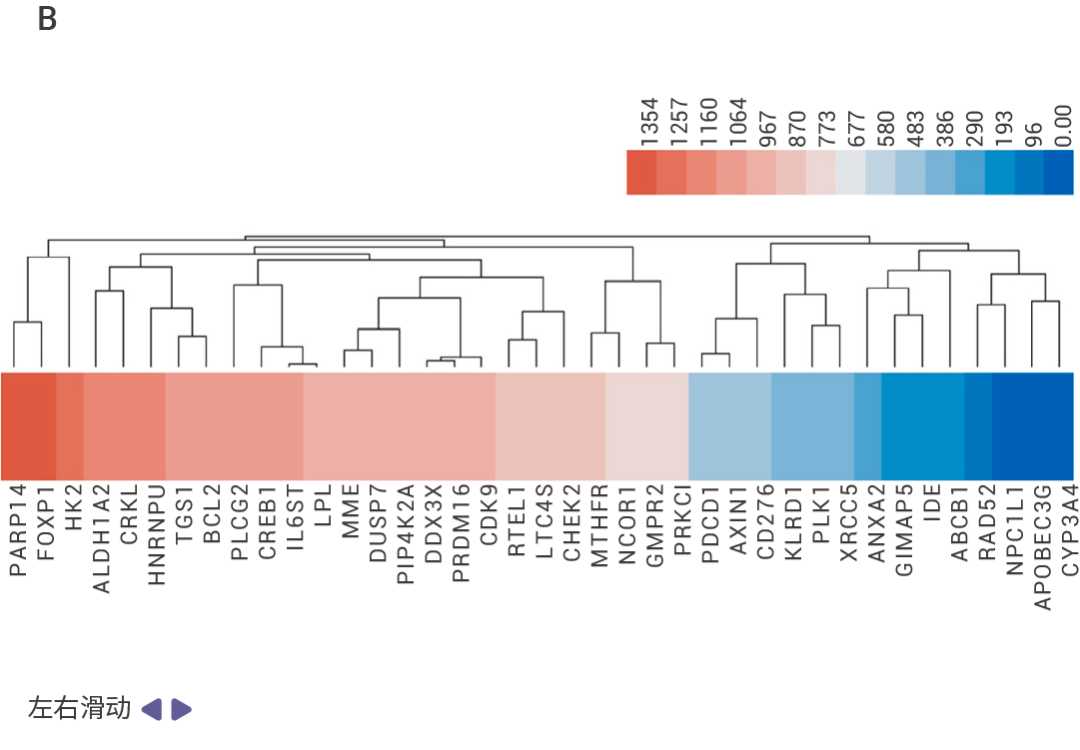
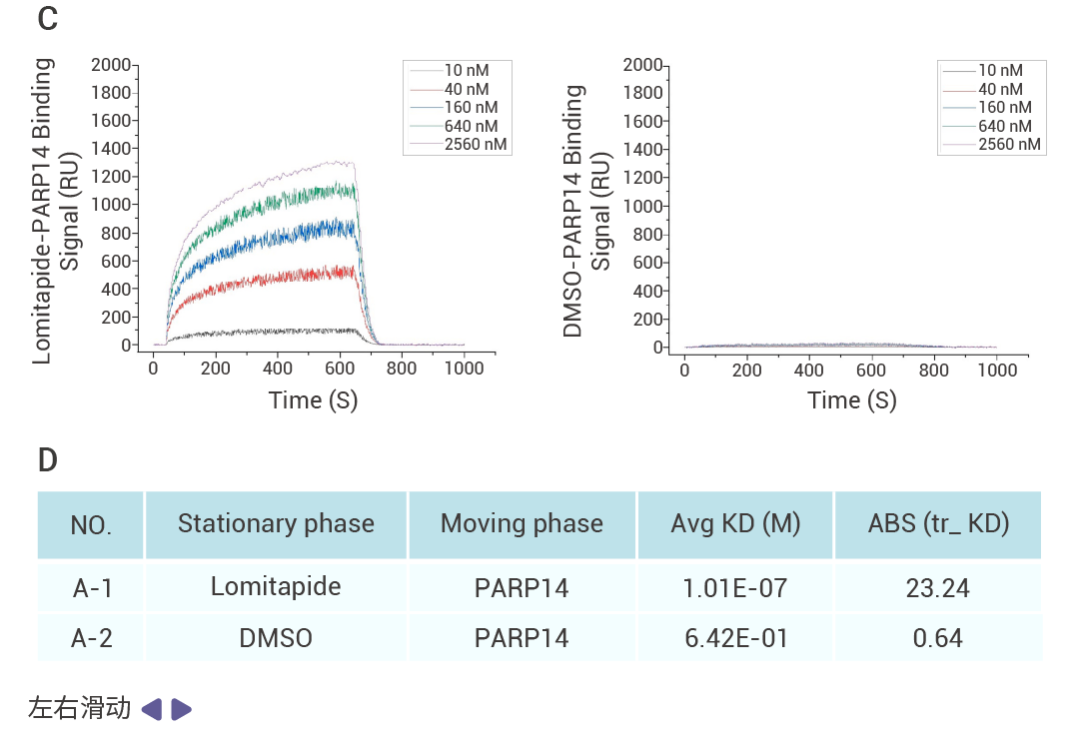
作者通過細胞活力、細胞凋亡等表型實驗從 1,504 種 FDA 上市藥物中篩選并驗證了 Lomitapide 對耐藥多發性骨髓瘤 (Multiple myeloma,MM) 細胞有很好的抗腫瘤活性,體內實驗也證實 lomitapide 可以抑制 MM 的疾病進程。
Section.04
SPIDER 鄰近標記
Pull Down 技術
特異性糖基化作為標識報告物 (Specific Pupylation as IDEntity Reporter, SPIDER) 是一種基于底物的鄰近標記活性和鏈霉親和素 (SA)-生物素系統來識別蛋白質-生物分子相互作用的方法。
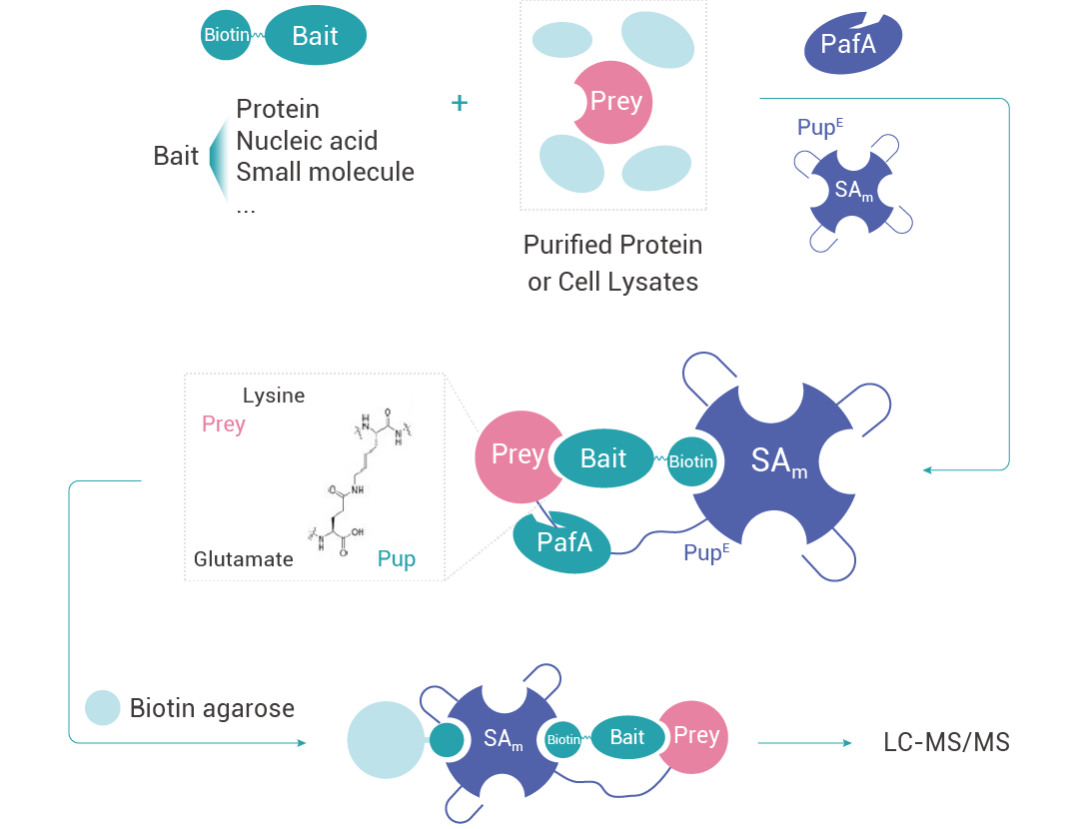
圖 5. SPIDER 技術原理示意圖。
對于實驗找靶而言,針對藥物特點選擇合適的實驗方案尤為重要,一起來看看上述 3 種藥物找靶技術各自的應用范圍吧!
表 2. 不同藥物找靶技術的特點及應用范圍。

那么有的小伙伴可能會問了,找到潛在結合蛋白之后,要如何驗證這些靶點是否是疾病的靶點呢?活性分子又是否是通過某個靶點發揮藥效的呢?別著急,后續的驗證方法小 M 也為你總結好了,噔噔噔噔~
表 3. 實驗找靶后續驗證方法舉例。




看了小 M 的介紹,大家現在有沒有一些找靶的思路了呢?MCE 藥物找靶平臺提供多種找靶技術,結合經驗豐富的蛋白表達純化和分子互作研究平臺,可以為藥物潛在靶點的識別和驗證提供全面和個性化的實驗方案。歡迎來和小 M 一起探討~
| 產品推薦 |
| 藥物找靶服務 MCE 提供多種找靶技術,為藥物潛在靶點的識別和驗證提供全面和個性化的實驗方案。 |
| SPR 檢測服務 MCE 使用 Biacore 8K、Biacore 1K、Biacore T200 等儀器,可以進行抗原-抗體、蛋白-蛋白、抗體-受體、核酸-蛋白、蛋白-小分子化合物等的親和力分析,能夠為客戶提供定制的多樣性服務。 |
| 分子互作檢測服務 MCE 擁有專業的分子互作檢測平臺,包括 SPR、BLI、ITC、MST 和 nanoDSF 等,可以快速評價分子間相互作用親和力,并提供基于親和力的藥物篩選服務。 |

[1] Isabella Gashaw, et al. What makes a good drug target?. Drug Discovery Today. 2012.S24-S30.
[2] Lomenick B, et al. Target identification using drug affinity responsive target stability (DARTS). Proc Natl Acad Sci U S A. 2009;106(51):21984-21989.
[3] Tan, XP., et al. Blockade of NMT1 enzymatic activity inhibits N-myristoylation of VILIP3 protein and suppresses liver cancer progression. Sig Transduct Target Ther 8, 14 (2023).
[4] Honghao Zhang, et al.Targeting PARP14 with lomitapide suppresses drug resistance through the activation of DRP1-induced mitophagy in multiple myeloma. Cancer Letters.2024.

免責聲明
- 凡本網注明“來源:化工儀器網”的所有作品,均為浙江興旺寶明通網絡有限公司-化工儀器網合法擁有版權或有權使用的作品,未經本網授權不得轉載、摘編或利用其它方式使用上述作品。已經本網授權使用作品的,應在授權范圍內使用,并注明“來源:化工儀器網”。違反上述聲明者,本網將追究其相關法律責任。
- 本網轉載并注明自其他來源(非化工儀器網)的作品,目的在于傳遞更多信息,并不代表本網贊同其觀點和對其真實性負責,不承擔此類作品侵權行為的直接責任及連帶責任。其他媒體、網站或個人從本網轉載時,必須保留本網注明的作品第一來源,并自負版權等法律責任。
- 如涉及作品內容、版權等問題,請在作品發表之日起一周內與本網聯系,否則視為放棄相關權利。
 手機版
手機版 化工儀器網手機版
化工儀器網手機版
 化工儀器網小程序
化工儀器網小程序
 官方微信
官方微信 公眾號:chem17
公眾號:chem17
 掃碼關注視頻號
掃碼關注視頻號
















 采購中心
采購中心